Derivati karboksilnih kiselina su jedinjenja koja nastaju zamenon –OH grupe karboksilne grupe nekim atomom ili atomskom grupom. Sve klase derivata karboksilnih kiselina sadrže acil ili alkanoli-grupu (ostatak karboksilne grupe).
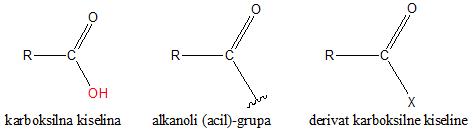
Najvažniji derivati karboksilnih kiselina su acil (alkanoil)-halogenidi, anhidridi kiselina, estri i amidi.
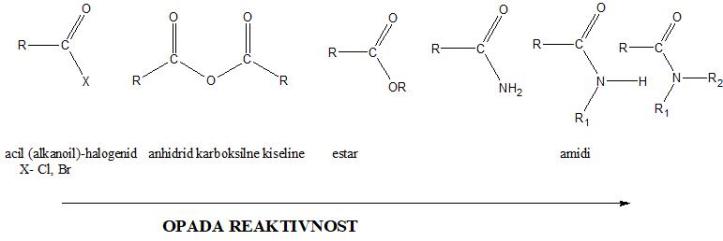
Svi derivati stupaju u reakcije nukleofilne supstitucije, gde se kao reagensi upotrebljavaju voda (hidroliza), alkoholi (alkoholiza) i amonijak (amonoliza). Ovim reakcijama se derivati međusobno mogu pretvarati jedni u druge.
ACIL (ALKANOIL) – HALOGENIDI
Formule acil-halogenida se mogu izvesti iz formule kaboksilne kiseline, zamenom –OH grupe atomom halogenog elementa.
Nomenklatura
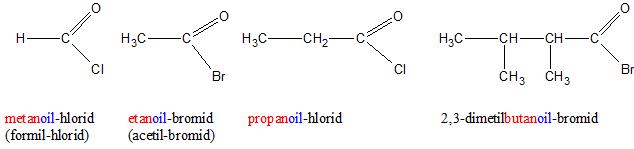
Acil-halogenidi se imenuju kao alkanOIL-halogenidi. Trivijalni nazivi se formiraju od naziva kiselina, odnosno soli karboksilnih kiselina.
Nalaženje u prirodi i dobijanje
U prirodi se ne nalaze u slobodnom stanju, isključivo su sintetičke supstance.
Mogu se dobiti u reakcijama karboksilnih kiselina sa fosfor (III)-halogenidima, fosfor (V)-halogenidima i tionil-hloridom (reakcije kao i kod alkohola, pogledati).
1) Reakcije karboksilnih kiselina sa fosfor (III)-halogenidima, PX3, X-Cl, Br
3RCOOH + PX3 → 3RCOX + H2PHO3
3CH3COOH + PBr3 → 3CH3COBr + H2PHO3
2) Reakcije karboksilnih kiselina sa fosfor (V)-halogenidima, PX5, X-Cl, Br
RCOOH + PX5 → RCOX + POX3 + HX
HCOOH + PCl5 → HCOCl + POCl3 + HCl
3) Reakcije karboksilnih kiselina sa tionil-hloridom, SOCl2
RCOOH + SOCl2 → RCOCl + SO2 + HCl
CH3CH2COOH + SOCl2 → CH3CH2COCl + SO2 + HCl
Fizičke i hemijske osobine
Acil-halogenidi su uglavnom tečnosti oštrog i veoma neprijatnog mirisa koje ključaju na nižim temperaturama od odgovarajućih karboksilnih kiselina jer nemaju mogućnost građenja vodoničnih veza. Na vazduhu se često puše zato što reaguju sa vlagom i oslobađaju odgovarajući halogenovodonik.

1) hidroliza (reagens je voda, H2O, H-OH)
Reakcijom hidrolize glavni proizvod je karboksilna kiselina iz koje je izveden acil-halogenid, a sporedni je halogenovodonik.
RCOX + H-OH → RCOOH + HX
HCOCl + H-OH → HCOOH + HCl
2) alkoholiza (reagens je alkohol, R1OH)
Reakcijom alkoholize glavni proizvod je estar,a sporedni je halogenovodonik.
RCOX + R1OH → RCOOR1 + HX
CH3COCl + CH3CH2OH → CH3COOCH2CH3 + HCl
3) amonoliza (reagens je amonijak, NH3, H-NH2)
Reakcijom amonolize glavni proizvod je amid karboksilne kiseline, a sporedni je halogenovodonik.
RCOX + H-NH2 → RCONH2 + HX
CH3COCl + H-NH2 → CH3CONH2 + HCl
Možete uočiti da se u svim navedenim reakcijama kao sporedni proizvod reakcije oslobađa halogenovodonik.
ANHIDRIDI KARBOKSILNIH KISELINA
U formulama anhidrida, dve acil-grupe su povezane atomom kiseonika i mogu biti jednake-simetrični anhidrdi ili različite-mešoviti anhidridi.
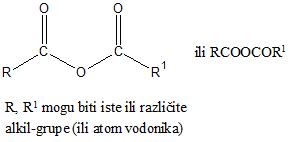
Nomenklatura
Simetrični anhidridi se imenuju kao alkananhidridi (ili trivijalnom nomenklaturom). U slučaju mešovitih anhidrida, imenovanje se vrši tako što se uz nazive karboksilnih kiselina doda reč anhidrid.
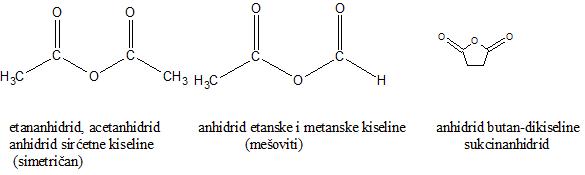
Nalaženje u prirodi i dobijanje
Kao i acil-halogenidi, u prirodi se ne nalaze u slobodnom stanju.
Mogu se dobiti reakcijom acil-halogenida i karboksilne kiseline ili acil-halogenida i soli karboksilne kiseline. Dikiseline sa 4 ili 5 atoma ugljenika zagrevanjem grade anhidride (ciklične) uz eliminaciju molekula vode.
1) reakcije karboksilnih kiselina sa acil-halogenidima
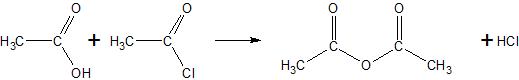
2) reakcije karboksilnih kiselina sa solima karboksilnih kiselina
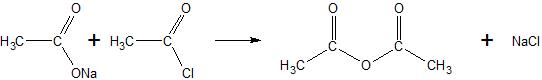
3) dobijanje anhidrida dikiselina (zagrevanjem uz eliminaciju molekula vode)
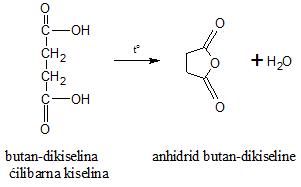
Anhidridi nekih dikiselina, kao što je oksalna, ne mogu se dobiti na ovaj način zbog termičke nestabilnosti takvih supstanci. Oksalna kiselina se zagrevanjem raspada na ugljen-monoksid, ugljen-dioksid i vodu.
Fizičke i hemijske osobine
Usled nemogućnosti obrazovanja vodoničnih veza, i ova klasa derivata karboksilnih kiselina ključa na nižim temperaturama u odnosu na karboksilne kiseline približnih molarnih masa.
1) hidroliza (reagens je voda, H2O, H-OH)
Reakcijom hidrolize nastaju dva molekula karboksilne kiseline iz koje je anhidrid izveden.
CH3COOCOCH3 + H-OH → CH3COOH + CH3COOH
2) alkoholiza (reagens je alkohol, R1OH)
Reakcijom alkoholize glavni proizvod je estar,a sporedni je odgovarajuća karboksilna kiselina.
RCOOCOR + R1OH→ RCOOR1 + RCOOH
CH3COOCOCH3 + CH3OH → CH3COOCH3 + CH3COOH
3) amonoliza (reagens je amonijak, NH3, H-NH2)
Reakcijom amonolize glavni proizvod je amid karboksilne kiseline, a sporedni je odgovarajuća karboksilna kiselina.
CH3COOCOCH3 + H-NH2 → CH3CONH2 + CH3COOH
Na osnovu prikazanih hemijskih reakcija, zaključujemo da je sporedni proizvod u svim navedenim reakcijama karboksilna kiselina.
ESTRI
Estri su derivati karboksilnih kiselina koji pored acil-grupe sadrže i alkoksi-grupu vezanu za karbonilni atom ugljenika.

Nomenklatura
Estri karboksilnih kiselina ili prosto estri, nazivaju se prema kiselini i alkoholu iz kojih su postali, alkil-alkanoati. Prilikom imenovanja se navodi ime alkil-grupe koja potiče iz alkohola (nastavak –il), a drugi deo naziva se odnosi na karboksilnu kiselinu, isti kao i u slučaju soli (nastavak – oat).
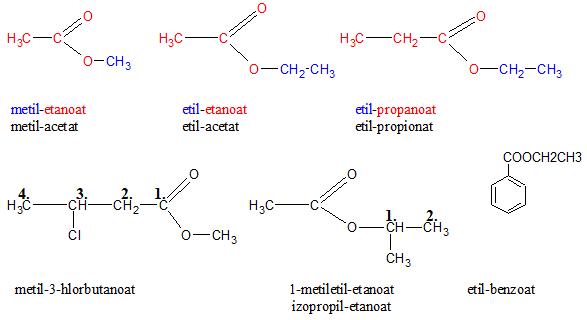
Nalaženje u prirodi i dobijanje
Estri su veoma rasprotranjeni u prirodi. Estri nižih alkohola i nižih monokarbokslilnih kiselina se nalaze u voću kome daju poseban miris i ukus. Ima ih i u živim bićima. Recimo estri masnih kiselina i trohidroksilnog alkohola glicerola sastavni su deo svake masti i ulja. Estri ulaze i u stastav voskova ( estri masnih kiselina i monohidroksilnih alkohola). Estri nalaze primenu u prehrambenoj industriji kao veštačke arome, ali se koriste kao rastvarači, boje, lakovi i kao sirovine za dobijanje veštačkih vlakana. Pojedine vrste estara se koriste u sredstvima protiv komaraca, lepkovima ili lakovima za kosu.
Estri se dobijaju ravnotežnom reakcijom esterifikacije (Fišerova esterifikacija) u kojoj učestvuju karboksilna kiselina i alkohol (ili fenol), a nastaju estar i voda. Reakcija se dešava u prisustvu katalitičkih količina neke mineralne kiseline (konc. sumporna, fosforna ili hlorovodonična kiselina) uz zagrevanje.
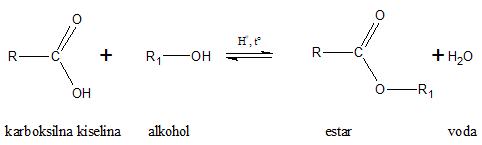
ili
RCOOH + R1OH ⇄ RCOOR1 + H2O
CH3COOH + CH3OH ⇄ CH3COOCH3 + H2O
HCOOH + C6H5OH ⇄ HCOOC6H5 + H2O
Estri se mogu dobiti u reakciji alkoholize acil-halogenida, anhidrida i amida.
Laboratorijski postupak sinteze estara možete pogledati ovde.
Fizičke i hemijske osobine
Estri su obično uljaste tečnosti ili kristalne supstance, karakterističnog mirisa ili niskih temperaturi ključanja i topljenja (ne grade vodonične veze). Sa povećanjem broja atoma ugljenika rastvorljivost estara u vodi opada. Rastvaraju se u nepolarnim rastvaračima.
1) hidroliza (reagens je voda, H2O, H-OH za potrebe neutralne hidrolize ili NaOH za slučaj bazne hidrolize)
Zagrevanjem estara sa vodom, u prisustvu katalitičkih količina neke mineralne kiseline, estri hidrolizuju u kiselinu i alkohol iz kojih su postali. Hidroliza estara je suprotna esterifikaciji.
RCOOR1 + H-OH ⇄ RCOOH + R1OH
CH3COOCH3 + H-OH ⇄ CH3COOH + CH3OH
Estri podležu i baznoj hidrolizi. U prisustvu alkalnih hidroksida (NaOH, KOH), iz estara nastaje so karboksilne kiseline i odgovarajući alkohol. Reakcija je ireverzibilna i često se naziva saponifikacija.
RCOOR1 + NaOH ⇄ RCOONa+ R1OH
CH3COOCH3 + NaOH → CH3COONa + CH3OH
Alkalne soli viših masnih kiselina se nazivaju sapuni.
2) alkoholiza (reagens je alkohol, R2OH); Reakcija transesterifikacije
Zagrevanjem estra sa nekim alkoholom dobija se drugi estar.
RCOOR1 + R2OH ⇄ RCOOR2 + R1OH
CH3COOCH3 + CH3CH2OH ⇄ CH3COOCH2CH3 + CH3OH
3) amonoliza (reagens je amonijak, NH3, H-NH2)
Zagrevanjem estara sa amonijakom ili nekim aminom, nastaje glavni proizvod amid i sporedni odgovarajući alkohol.
RCOOR1 + H-NH2 ⇄ RCONH2 + R1OH
HCOOCH3 + H-NH2 ⇄ HCONH2 + CH3OH
4) Redukcija estara
Redukcijom estara sa litijum-aluminijum-hidridom nastaju odgovarajući alkoholi.
RCOOR1 → RCH2OH + R1OH
CH3COOCH3 → CH3CH2OH + CH3OH
AMIDI
Amidi su derivati karboksilnih kiselina koji sadrže acil-grupu i primarnu amino- ili supstituisanu amino-grupu. Prema broju atoma ugljenika koji su vezani za atom azota, razlikujemo primarne (1⁰), sekundarne (2⁰) i tercijarne (3⁰) amide.
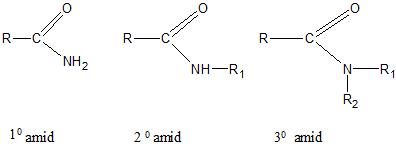
Nomenklatura
Primarni amidi se imenuju kao alkanamidi. U slučaju sekundarnih i tercijarnih amida, uz naziv alkil-grupe vezane za atom azota dodaje se veliko latinično slovo N. . Ako je jedna alkil-grupa vezana za atom azota, naziv se formira kao N-alkilalkanamid. Ukoliko su dve iste alkil-grupe vezane za atom azota koristi se N, N-, odnosno naziv N, N-dialkilalkanamid. U slučaju da su dve različite alkil- grupe vezane za atom azota, svaka grupa se uz oznaku N imenuje odvojeno.
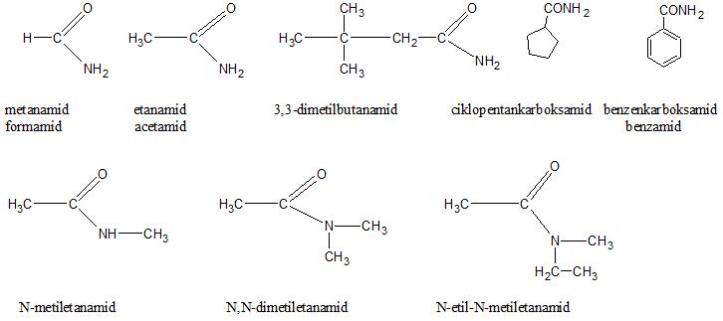
Nalaženje u prirodi i dobijanje
Mnogi biomolekuli sadrže amidne grupe, od kojih su svakako najvažniji proteini. Amidne strukture se nalaze i u manjim grupama kakve su karbamid (urea), nikotinamid (vitamin B3), mokraćna ili urična kiselina i drugi. Pojedini alkaloidi i antibiotici (Penicillin) su takođe po hemijskom sastavu amidi.
Pored reakcija amonolize acil-halogenida, anhidrida i estara, amidi se mogu dobiti i zagrevanjem (pirolizom) amonijum-soli karboksilnih kiselina.
RCOONH4 → RCONH2 + H2O
CH3COONH4 → CH3CONH2 + H2O
Fizičke i hemijske osobine
Od svih derivata kiselina amidi imaju najviše tačke topljenja i ključanja (primarni i sekundarni amidi mogu formirati vodonične veze). U vodi se rastvaraju amidi sa manjim brojem atoma ugljenika, dok sa povećanjem broja C-atoma rastvrljivost u vodi opada.
1) hidroliza (reagens je voda, H2O, H-OH)
Reakcijom hidrolize nastaje karboksilna kiselina iz koje je amid izveden i amonijak.
RCONH2 + H-OH ⇄ RCOOH + NH3
HCONH2 + H-OH ⇄ HCOOH + NH3
2) alkoholiza (reagens je alkohol, R1OH)
Reakcijom alkoholize glavni proizvod je estar,a sporedni je amonijak.
RCONH2 + R1OH ⇄ RCOOR1 + NH3
CH3CONH2 + CH3OH ⇄ CH3COOCH3 + NH3
3) Redukcija amida
Redukcijom amida (uz litijum-aluminijum-hidrid) nastaju amini.
RCONH2 + 4[H] → RCH2NH2 + H2O












